mjhalpern@sapo.pt
QUIMICA ORGANICA
Elementos e atomos
Ligações interatomicas
Ligações intermoleculares
Quimica do carbono
Hidrocarbonetos
Grupos funcionais
Isomerias
Importancia biologica das isomerias
Espaço e tempo
Estrutura da agua
ELEMENTOS E ATOMOS
Matéria
Qualquer objecto que nos
rodeia é constituido por matéria
Matéria é tudo o que ocupa
espaço ou volume
Elementos
São as unidades estruturais da
matéria.
96% da massa corporal está
representada por quatro elementos – carbono, oxigénio, hidrogénio e
azoto
Elementos do corpo humano
Elementos
|
Símbolo
|
% da massa corporal
|
PRINCIPAIS
Oxigénio
Carbono
Hidrogénio
Azoto
|
-
O
C
H
N
|
96,1
65,0
18,5
9,5
3,2
|
Constituição atomica comparada do corpo
humano
É curioso
notar que, devido à selectividade da evolução, a constituição em átomos do
corpo humano é completamente diferente da água do mar e da crosta
terrestre
Constituição atómica comparada do corpo
humano
(% do
número total de átomos)
Corpo humano
|
Água do mar
|
Crosta terrestre
|
|
Hidrogénio
Oxigénio
Carbono
Azoto
Cálcio
Fósforo
Cloro
Potássio
Enxofre
Sódio
Magnésio
Silício
Alumínio
Ferro
|
63
25,5
9,5
1,4
0,31
0,22
0,03
0,06
0,05
0,03
0,01
¾
¾
¾
|
66
33
0,0014
¾
0,006
¾
0,33
0,006
0,17
0,28
0,033
¾
¾
¾
|
0,22
47
0,19
¾
3,5
¾
¾
2,5
¾
2,5
2,2
28
7,9
4,5
|
Estrutura do atomo
Atomo provem da
palavra grega átomos significando indivisivel
Os átomos definem-se como as particulas mais pequenas em que
um elemento se pode dividir sem perda das suas propriedades
Protões, neutrões, electrões.
O átomo tem um núcleo central constituido por protões de
carga positiva e neutrões sem carga. O núcleo tem portanto uma carga
positiva.
À volta do nucleo rodam electrões
de carga negativa, igual à carga positiva do núcleo
.
Particulas elementares
Mesões
Durante muito tempo os cientistas procuraram como explicar
por que tendo os protões a mesma carga,
não se repeliam. A resposta foi dada em 1947 com a descoberta dos mesões, partículas neutras intercaladas
entre os neutrões
Quarks
A ideia que o átomo era a parte mais pequena da matéria,
proposta por Democrito no seculo V A.C. perdurou até 1965
Quando Murray Gell- Mann sugeriu que a matéria poderia bser
dividida em partículas mais pequenas, os quarks
Há seis
tipos de quarks: u (Up), d(down), s (stange), c ( charm),t (top), b ( bottom)
Só os d e os u entram na composição dos protões e dos
neutrões. Os outros só existiram na formação do universo
Os protões têm 2u e
1d
Os neutrões têm 2d e
1u
Neutrões
Os quarks são mantidos juntos por gluões
Neutrinos
Em 1930 Pauli em 1930 para explicar a radioactividade beta
idealizou que um neutrão transformar-ser-ia num protão pela emissão de um
electrão (radiação beta) e de uma outra particula sem carga eléctrica que posteriormente Fermi
em 1933 designou como neutrino
Neutrão ------------- Protão
Neutrino
Emissão do neutrino
A sua massa, extremamente pequena só foi detectada em 1998,
sendo 50.000 vezes menor que a do electrão
.
O que liga os electrões ao nucleo?
Como o nucleo tem uma carga positiva e os electrões
negativa, exerce-se entre eles uma interacção electromagnetica que os
mantem unidos.
Alguns números
Alguns números sobre o átomo
Principio da incerteza de Heisenberg
Os electrões movem-se a grande velocidade, como uma nuvem, à volta do
núcleo.
Ver animação
http://www2.nl.edu/jste/atomanim.htm
Esta realidade está expressa no principio da incerteza de Heisenberg. Este principio afirma que é
impossivel determinar ao mesmo tempo a posição e a velocidade de um electrão
A distribuição de um electrão terá de ser feita em termos de
probabilidades.
A dualidade
onda-corpusculo
No fim do século XIX, MAXWELL definiu a luz como um feixe de
ondas electromagnéticas deslocando-se a uma velocidade constante no
vácuo(300.000 km/s)
PLANCK e PLANCK introduziram a noção de luz emissão de
corpúsculos que EINSTEIN definiu e caracterizou como fotões
Nasceu assim a dualidade onda-corpusculo em que a luz ao
mesmo tempo que emite corpúsculos propaga-se no espaço como as ondas do mar
Modelo de Bohr
Foi o primeiro modelo a ser proposto
O modelo foi proposto para explicar porque é que os
electrões não caíam para o nucleo e tambem para explicar algumas linhas
espectrais observadas
Para BOHR a energia do electrão estaria quantizada, ou seja,
a disposição de um electrão à volta do
núcleo dependeria da sua energia
Fotões
O modelo de BOHR já explicava a emissão de luz pelo átomo
Para BOHR quando o electrão salta de uma orbita de energia
maior para uma de energia menor o electrão cede a sua energia sob a forma de um
fotão emitido para o exterior e o átomo
fica no estado excitado
Fotões
A energia do fotão
será um múltiplo de um quanta de energia correspondendo à expressão hv em
que h é a constante de Planck e v a
frequência da luz ( numero de oscilações por segundo)
A frequencia da luz
ou comprimento de onda é a distancia entre dois pontos correspondentes em vagas
adjacentes
Estado
excitado
O electrão para mudar de órbita necessita de energia (
absorção de luz, colisão com outros electrões) passando para o estado
excitado, libertando um fotão
Estado excitado
Estado fundamental
As diferenças de energia entre os estados fundamental e
excitado não são graduais, mas fazem-se por saltos correspondendo cada salto a
um quantum de energia, sendo
corporizados pela captação ou emissão de um fotão.
Números quanticos
São as coordenadas necessárias para definir uma órbita.
Existem quatro números quanticos:
¨
Principal
¨
Secundário
¨
Magnetico
¨
Rotacional
Número quantico principal
Para definir uma órbita circular correspondendo ao modelo de
BOHR basta uma coordenada, o número
quantico principal designado por n
O número quantico pode-se numerar de 1 a 7
Tambem se pode designar por maiusculas, a partir de K (K, L,
M ,...)
Números quânticos principais
Números quânticos principais
Número quantico secundário
No modelo de SOMMERFIELD as órbitas são elipticas, sendo
assim precisas duas coordenadas para as definir:
¨
Grande eixo – corresponde ao numero quantico principal
¨
Excentricidade representada pelo número
quantico secundário ou azimutal l
Animações
Designação dos números
quanticos secundários
Os números quanticos secundários podem ir de 0 a n-1
Designam-se por
numeros (1,2,3...) ou letras – s
(sharp), p ( principal) , d ( difuse) , f ( fundamental)
Números quânticos secundários
Número
|
Letra
|
1
2
3
4
|
S
p
d
f
|
Niveis e subniveis
O número quantico principal define niveis e o secundario
subniveis
Para referenciar o
subnivel, o numero quantico principal designa-se por numeros e o secundário por letras
Níveis e subniveis
N
|
1
|
Subnível
|
1
2
3
|
0
0
1
0
1
2
|
1s
2s
2p
3s
3p
3d
|
Configuração
electrónica
Os electrões das camadas internas afastam do nucleo os da camada externa
Algumas orbitas penetram mais no nucleo que outras, sendo
por ordem crescente s, p, d, f
Há portanto niveis de
energia diferentes em varios subniveis pertencendo ao mesmo numero quântico
Níveis energeticos
Ilustrações
Numero quantico magnetico
Electrões com o mesmo subnivel podem mostrar energias
ligeiramente diferentes sob a acção de um campo magnetico
O numero quantico magnetico m pode ter valores de +1,
0 e –1. fig. 238 e 239N
Orbitas de números quânticos magnéticos 0,+1 e
-1
Orbitas
Os três primeiros numeros quanticos definem orbitas
Órbitas possíveis para os 4 primeiros numeros quanticos
Órbitas possíveis
|
|||||||
Números quânticos
|
Órbitas
|
||||||
n
|
l
|
m
|
S
|
P
|
D
|
f
|
|
1
|
0
|
0
|
1
|
-
|
-
|
-
|
|
2
|
0
1
|
1
- 1,0 + 1
|
1
-
|
-
3
|
-
-
|
-
-
|
|
3
|
0
1
2
|
0
-1,0 + 1
- 2 a + 2
|
-
-
|
-
3
-
|
-
-
3
|
-
-
-
|
|
4
|
0
1
2
3
|
0
- 1 a + 1
- 2 a + 2
- 3 a + 3
|
1
-
-
-
|
-
3
-
-
|
-
-
5
-
|
-
-
-
7
|
|
M
|
Numero quantico rotacional ou spin
O electrão para lá de rodar sobre
o nucleo roda tambem sobre si proprio, resultando uma diferença de energia,
definida pelo numero quantico rotacional ou spin
O spin pode ser de + ½ ou de – ½
Spin
Resumo
Números quânticos
|
||
Número
quântico
|
Características
|
|
Secundário
Magnético
Spin
|
Níveis
Excentricidade
Subníveis
Orientação
Rotação
|
Definem
Órbitas
|
Principio da exclusão de PAULI
Segundo este
principio não podem haver dois electrões com os quatro numeros quanticos iguai
Se numa órbita
existirem dois electrões com spin ½, um
terá de ter +1/2 e outro – ½ para não
terem todos os numeros quanticos iguais. Estes electrões dizem-se emparelhados
Se a órbita
tiver apenas um electrão, este diz-se celibatário
Electrões
celibatários e emparelhados
Numero
máximo de electrões em cada nivel
Este quadro mostra que o número máximo de electrões em cada
nivel é 2n
Exceptua-se o ultimo nivel que terá o maximo de 8 e o penultimo com o maximo de
14
Regras para o preenchimento das órbitas
As órbitas com menor nível de energia preenchem-se primeiro (princípio
de Aufbau).
Segundo o princípio de exclusão de Pauli uma órbita não pode ser
ocupada por mais de dois electrões e estes de spin oposto.
Quando uma órbita com a mesma
energia está vazia, esta será preenchida antes que outra órbita adquira um segundo electrão (regra de Hund).
Recordando
·
Os
níveis são definidos pelo número quântico principal
·
Os
subníveis são definidos pelo número quântico secundário
·
Os
níveis ocupam-se pela ordem 1, 2, 3 … (K, L, M …)
·
Os
subníveis ocupam-se pela ordem s, p, d, f …
No quadro seguinte
indicamos a configuração dos dez primeiros elementos
Configuração dos primeiros dez elementos
Elemento
|
Número
atómico
|
Configuração
electrónica
|
Número de electrões em cada órbita
|
||||
1s
|
2s
|
2px
|
2py
|
2pz
|
|||
H
|
1
|
1s1
|
1
|
||||
He
|
2
|
1s2
|
2
|
||||
Li
|
3
|
1s22 s1
|
2
|
1
|
|||
Be
|
4
|
1s22 s2
|
2
|
2
|
|||
B
|
5
|
1s22 s22 p1
|
2
|
2
|
1
|
||
C
|
6
|
1s22 s22 p2
|
2
|
2
|
1
|
1
|
|
N
|
7
|
1s22 s22 p3
|
2
|
2
|
1
|
1
|
1
|
O
|
8
|
1s22 s22 p4
|
2
|
2
|
2
|
1
|
1
|
F
|
9
|
1s22 s22 p5
|
2
|
2
|
2
|
2
|
1
|
Ni
|
10
|
1s22 s22 p6
|
2
|
2
|
2
|
2
|
2
|
Bibliografia
Número atómico
O número
atómico de um átomo, designado por Z,
é igual ao número de protões que contém. O hidrogénio tem o número
atómico de 1 porque tem apenas um protão, o hélio de 2, etc. Indica-se um
algarismo colocado em baixo e à esquerda
Atendendo que
o número de electrões é igual ao de protões, o número atómico também indica o
número de electrões.
Numero de massa
O número de massa de um átomo
é a soma da massa dos protões e dos neutrões. Atendendo ao seu valor muito
baixo, a massa dos electrões não é considerada. Como o hidrogénio só contém um
protão, a sua massa é 1. Como o hélio tem 2 protões e dois neutrões , a sua
massa é de 4. A massa do hidrogénio tornou-se assim a unidade de massa. O
número de massa designa-se por um símbolo colocado em cima e à esquerda
Massa atómica
É a massa do atomo
É sensivelmente igual ao numero de massa visto que a massa
dos electrões é praticamenta nula
A sua unidade é 1/12 da massa do carbono
A massa do hidrogenio é 1,008
Isotopos
Quase todos os elementos contêm pelo menos duas variedade de átomo, os isótopos,
que têm o mesmo número atómico mas diferem no número de massa por terem um
número diferente de neutrões.
O isótopo é
designado pelo número de massa, colocando-o como é norma em cima e à esquerda
do símbolo do elemento. Também se pode representar escrevendo o número de massa
após o símbolo: H-1, H-2, H-3.
Isótopos do hidrogenio
Radioactividade
Em 1896 BECQUEREL constatou que deixando uranio ao
lado duma placa fotográfica, esta ficava impressionada, concluído que o
uranio emita uma radiação espontânea, os
raios uranicos. Os esposos CURIE ao estudar este fenómeno, isolaram dois novos
elementos que designaram como polónio e rádio e deram ao fenomeno descrito por
BECQUEREL o nome de radioactividade.
Existem três tipos de radioactividade,
caracterizados pela emissão de radiações diferentes
Tipos de radiações
Tipo de radiações
Radiações alfa
São constituídas por dois protões e dois neutrões
como um núcleo de hélio, portanto com carga positiva.
São fragmentos de núcleos pesados instáveis que se
reorganizam para formar núcleos mais ligeiros, estáveis e consequentemente não
radioactivos.
São partículas pouco penetrantes – são paradas por
6 cm. de ar
Radiações beta
São constituídas por electrões, sendo portanto de
carga negativa. São equivalentes aos raios catódicos da televisão.
Radiações gama
São
constituídas por fotões, de alta energia. O electrão passa para uma camada interna,
menos energética, libertando um fotão que sai do átomo como radiações gama..
São muito penetrantes, podendo atravessar um cofre
forte.
Emissão das radiações
Um átomo não emite simultaneamente estas radiações,
pois que só pode emitir uma de cada vez.
Radioactividade natural
Deve-se a elementos de longa duração formados nas
estrelas que não encontraram ainda a sua estabilidade. A energia libertada por
esta radioactividade mantem a magma em fusão sob a crosta terrestre.
No centro do Sol, a sua temperatura de milhões de
graus deve-se a fenómenos de fusão nuclear.
Radioactividade artificial
Neste caso os laboratórios fabricam radioelementos artificiais.
Fissão nuclear
Os radioelementos obtêm-se bombardeando com
neutrões o núcleo de um átomo pesado como o uraneo 235. Os núcleos formados têm
uma massa inferior à do núcleo original. A
massa que falta foi transformada numa enorme quantidade de energia. No
caso do uraneo 235 a fissão produz outros neutrões que irão cindir outros
núcleos de uraneo – é uma reacção em
cadeia.
Esta energia quando utilizada numa central nuclear produz
electricidade. Quando descontrolada é altamente destrutiva (bomba atómica)
Fissão nuclear
Fusão nuclear
É grosseiramente o inverso da fissão.
Dois núcleos ligeiros como os do hidrogénio chocam
e fundem-se num núcleo maior mas menor que a soma dos iniciais, o que implica
uma grande libertação de energia.
Para fazer
tal reacção é necessário obrigar os núcleos, todos de carga positiva, a vencer
a repulsão exercida por partículas de cargas iguais, o que se consegue com
temperaturas elevadíssimas (reacção termonuclear).
Esta reacção não controlada é usada na bomba de
hidrogénio.
Fissão nuclear
IMPORTÂNCIA
CLÍNICA DAS PARTÍCULAS ATÓMICAS
Os isótopos radioactivos têm um núcleo
instável, podendo perder protões ou neutrões, com emissão de radiações.
As radiações produzidas por alguns isótopos
podem destruir células. Como as células em divisão rápida são muito mais
sensíveis, estas são um meio muito útil para destruir células cancerosas.
Como
as radiações podem ser detectadas, estas também podem ser um meio de
diagnóstico. É assim que a administração de iodo radioactivo pode ser usada
para medir a captação de iodo pela célula tiroideia, permitindo diagnosticar
casos patológicos.
Os raios X são um tipo de radiação que se
forma quando os electrões perdem energia deslocando-se de um estado de alta
energia para um estado de energia mais baixa. Usando computadores podem
analisar-se radiografias seriadas de uma zona, dando uma imagem
tridimensional. É a radiografia
computerizada.
Na imagiologia por ressonância magnética
(MRI), o doente é colocado num campo magnético poderoso que alinha o núcleo de
hidrogénio. As radioondas produzidas pelo núcleo do hidrogénio são
monitorizadas e tratadas pelo computador. Este método é muito eficaz no estudo
dos tecidos moles, atendendo à riqueza destes em água.
Átomo-grama
É o numero de gramas correspondendo à massa atomica
O atomo grama do hidrogenio é 1,008 g.
Contem 6,2 x 10(23) atomos (numero de Avogadro
Calcula-se dividindo o peso em gramas pelo peso atomico
Tabela
periodica
Quando os elementos são seriados pela ordem crescente do seu
número atómico, as suas propriedades repetem-se ciclicamente
A tabela atómica de MENDELIEV está organizada para mostrar
estas repetições ciclicas
Os grupos colocados na vertical têm propriedades semelhantes
e designam-se como grupo ou familia
Cada linha horizontal representa um período
Tabela periódica
Em http://elements.vanderkrogt.net/ptable.html encontra-se uma tabela periódica com muitas
informações como a tradução do nome dos elementos em varias línguas.Em http://elements.vanderkrogt.net/index.html
encontram-se informações sobre etimologia, tradução e historia
Bibliografia –
elementos
Bibliografia – átomos
CAPITULO 2
Ligações interatomicas
Definições
Os átomos
combinam-se entre si por ligações químicas. As ligações
químicas não podem ser consideradas como
algemas ou nós que ligam pessoas entre si. São apenas relações energéticas
entre os electrões das camadas externas dos átomos que participam nas ligações.
Há ligação química quando os electrões se transferem
ou partilham entre si os átomos. As ligações podem ser interatómicas ou
intermoleculares
Ligações interatomicas e intermoleculares
.
Diz-se que se estabelece uma ligação química entre
os átomos quando as forças criadas mantêm uma estrutura suficientemente estável
para o composto criado se poder considerar uma espécie química independente.
Regra
do octeto
Os gases perfeitos (hélio,
néon, argon, cripton, xenon e radon) têm uma reactividade mínima e por isso se
chamam inertes.
Esta propriedade deve-se a todos terem oito electrões na camada externa,
excepto o hélio que tem dois. Quer dizer, todos estes átomos têm o número
máximo de electrões na camada externa.
Todos os outros átomos têm tendência a ganhar ou perder electrões para
ficarem com oito electrões na camada externa. Para atingir este objectivo
interagem entre si ganhando, perdendo ou partilhando electrões para formar
moléculas.
É a regra do octeto – os
átomos têm tendência a reagir com outros átomos para preencher a sua camada
externa com 8 electrões, e assim
adquirirem estabilidade.
http://ull.chemistry.uakron.edu/genobc/Chapter_04/
cortesia de James Hardy
Gases perfeitos
Tipos de ligações
Segundo a regra do
octeto, os atomos têm tendência a completar a sua camada externa com um numero
estável de electrões ( 8 segundo a regra do octeto). Para conseguir este objectivo, os átomos relacionam-se com outros átomos dando,
recebendo ou partilhando electrões, formando moléculas por ligações
interatomicas. Consideraremos os seguintes tipos de ligações:
Ø Iónicas
Ø Covalentes
Ø Coordenadas
Ligações
ionicas
Há transferencia completa de um electrão de um atomo para
outro
O atomo que cede um electrão fica com carga positiva,
transformando-se num catião
O atomo que recebe o electrão fica com uma carga negativa,
transformando-se num anião
cortesia de Michael Gregory
cortesia de Anne Marie Bernier

cortesia de Anne Marie Bernier
Ligação
ionica
Ver animação em
Constituição da ligação iónica
Tendo os aniões e catiões cargas eléctricas diferentes, eles
atraem-se entre si, formando-se um
composto por ligação iónica.
Para melhor compreensão vejamos o caso do cloreto de sódio
O sódio tem 1 electrão na camada externa o que o coloca como dador de
electrões.
O sódio tem sete na camada externa, o que o torna um aceitador
de electrões.
Criam-se assim condições para o
sódio ceder um electrão ao cloro, ficando o primeiro com uma carga
positiva e o segundo negativa. A força electrostática criada pela proximidade
de duas cargas opostas permite assim a formação do cloreto de sódio por ligação
iónica
Formação de
uma ligação iónica
Pode estar envolvido mais de um electrão. Os
electrões cedidos por um ou mais átomos devem ser aceites por um ou mais átomos
Ligações envolvendo vários electrões
O número de electrões cedidos ou recebidos,
constitui a valência, positiva ou negativa.
Sais
A maior parte dos compostos formados por ligação iónica entram na
categoria química dos sais.
Na ausência de água, os compostos
iónicos não se encontram como moléculas individuais mas sob a forma de grandes
agregados de aniões e catiões, os cristais, mantidos por ligações iónicas
cortesia de Michael Gregory
Cristais
Animação
Ligações covalentes
Na ligação covalente em vez de haver uma transferência completa de
electrões, os átomos partilham entre si electrões.
Quando os átomos estão
próximos, a carga positiva de um núcleo atrai
também o electrão do dois átomos e assim os dois electrões são partilhados
pelos dois átomos – formou-se outro átomo. A uma distância óptima os dois
núcleos atraem simultaneamente os electrões dos uma ligação covalente
Ligação covalente
Animação
www2.nl.edu/jste/bonds.htm
Um exemplo de ligação
covalente é a ligação de dois átomos de hidrogénio para formar a molécula de
hidrogénio H2 ou o CH4
cortesia de Michael Gregory
Agua
.
Metano (CH4)
Spins
Os electrões a
partilhar são celibatários, preenchendo simultaneamente as duas órbitas
Os electrões partilhados têm spins opostos
Spins opostos
Ligações simultaneas
Podem formar-se
simultaneamente várias ligações covalentes. É o caso da partilha dos electrões
de quatro átomos de hidrogénio com um de carbono para formar o metano quatro
electrões na camada externa, ao partilhar estes electrões fica com oito na
camada externa ficando esta estabilizada
A partilha pode fazer-se com átomos iguais ou diferentes
Ligações
simples, duplas e triplas
Nos exemplos anteriores cada átomo partilhava um electrão – ligação covalente simples.
Há casos em que se partilham dois ou três pares
de electrões – as ligações dizem-se duplas
ou triplas respectivamente
cortesia de Michael Gregory
Partilha de mais de um par de electrões
Notação das
ligações covalentes
As ligações covalentes designam-se introduzindo traços
entre os símbolos dos átomos, uma se for simples, duas se for dupla e três se for tripla
Notação das ligações covalentes
Notação de Lewis
As ligações
covalentes representam-se como dois pontos entre átomos
http://en.wikipedia.org/wiki/Lewis_structure

http://www.google.pt/imgres?imgurl=http://www.green-planet-solar-energy.com/images/lewis-dot-structures.gif&imgrefurl=http://www.green-planet-solar-energy.com/lewis-dot-structure.html&h=337&w=500&sz=22&tbnid=fvLGteNDw0OZRM:&tbnh=79&tbnw=117&prev=/search%3Fq%3Dlewis%2Bnotation%26tbm%3Disch%26tbo%3Du&zoom=1&q=lewis+notation&usg=__ctCzCpTAi7fhsTLL4mg7wYE4PLM=&docid=O4dKyZLUygAomM&hl=pt-PT&sa=X&ei=3rCQUb-gBa6P7Ab52oFo&sqi=2&ved=0CF4Q9QEwBw&dur=615
http://en.wikipedia.org/wiki/Lewis_structure
http://fisicosequimicos.blogspot.pt/2010/12/notacao-de-lewis.html
Bibliografia
Poder
combinante
O número de ligações covalentes que cada
átomo pode formar (poder combinante) depende da sua posição na
tabela periódica e implica a existência de átomos electropositivos e
electronegativos.
Os mais electronegativos são os dos grupos
VIA e VIIA.
A electronegatividade aumenta da esquerda
para a direita e de baixo para cima .
Os
átomos mais electropositivos são os do grupos IA e IIA
H
|
||||||||||
IA
|
IIA
|
IIIA
|
IVA
|
VA
|
VIA
|
VIIA
|
FAZER
|
|||
Li
|
Be
|
B
|
C
|
N
|
O
|
F
|
||||
Na
|
Mg
|
Al
|
Si
|
P
|
S
|
Cl
|
||||
ELECTROPOSITIVOS
Ligação iónica
|
Ligação covalente
|
ELECTRONEGATIVOS
Ligação covalente
Ligação iónica
|
||||||||
Poder combinante
Moleculas polares e não polares
Quando os electrões são partilhados igualmente pelos átomos, a molécula
formada não tem carga eléctrica e diz-se apolar
ou homopolar. Caso contrário, terá
carga eléctrica e chamar-se-á polar.
Explicação da polaridade
De um modo geral os átomos com 6 ou 7 electrões de valência, como o
oxigénio, o azoto e o cloro, atraem fortemente os electrões – são electronegativos.
Os átomos com l ou 2 electrões de valência como o potássio e o sódio,
atraem pouco os electrões – são electropositivos.
A criação de moléculas polares têm a ver não só com a
electronegatividade e positividade dos átomos mas também com a estrutura
tridimensional.
Anidrido
carbonico, molecula apolar
No CO2 o
carbono partilha 4 pares de electrões com dois
átomos de oxigénio, ou seja, 2 pares para cada átomo.
Sendo o oxigénio muito
mais electronegativo que o carbono, este atrai muito mais os electrões que o carbono.
Como a molécula é linear, a acção exercida por um átomo de
oxigénio é contrabalançada pela do outro e a molécula fica apolar
Agua, molecula
polar. Dipolo
A molécula de
água (H2O) tem a forma de um V , estando os dois átomos de
hidrogénio na mesma extremidade da molécula e o de oxigénio na extremidade
oposta
http://faculty.clintoncc.suny.edu/faculty/Michael.Gregory/files/Bio%20101/Bio%20101%20Lectures/Chemistry/chemistr.htm
cortesia de Michael Gregory
Nesta posição o oxigénio pode atrair os electrões partilhados criando-se
uma assimetria que cria uma molécula polar ou dipolo.
Bibliografia
Diferença
entre ligações iónicas, polares e apolares
Diferenças entre as ligações
Iónicas
|
Polares
|
Apolares
|
|
Electrões
|
Transferência completa
|
Partilha desigual
|
Partilha igual
|
Cargas
|
Partículas carregadas (iões)
|
Negativa numa
extremidade
e positiva
noutra
|
Equilibrada
|
Exemplo
|
Na+ Cl-
Cloreto de
sódio
|
H-O-H
|
O = C
= O
Anidrido carbónico
|
Ligação
coordenada ou dativa
Neste caso, o par de
electrões é fornecido pelo mesmo átomo. Representa-se por uma seta partindo do
átomo que cede o par de electrões:
O átomo que cede o par de electrões denomina-se dador e o que recebe, receptor
O dador deve possuir um par de electrões celibatários e o receptor uma órbita externa
incompleta
Exemplo da amónia
O caso mais
simples é o ião amónio
no NH3. O N tem
dois electrões não emparelhados e o H
não em nenhum. Nestas condições, o N compartilha os seus electrões com o H.
Capitulo 3
LIGAÇÕES INTERMOLECULARES
As ligações
que estudámos unem os átomos entre si para formar moléculas. Em muitos casos as
moléculas unem-se entre si para formar
compostos mais complexos.
Forças de van der Waals
São forças atractivas não específicas entre dois átomos muito próximos.
Produzem-se quando átomos
pertencentes a moléculas diferentes estão de tal modo próximos que o campo
eléctrico produzido pela rotação dos electrões num deles, possa produzir a
polarização em sentido oposto do outro, produzindo um efeito electromagnético
de atracção
Ligações hidrófobas
As cadeias
laterais de algumas moléculas são hidrófobas, o que pode levar a estas cadeias
repelirem moléculas de água que as separam e cairem no alcance das forças de
Van der Waals
Ligações ponte de
hidrogénio
O hidrogenio
forma ligações covalentes polares, tornando-se um centro de cargas positivas
Se o
hidrogénio estiver proximo de um atomo electronegativo suficientemente pequeno
(F, O, N ), para se aproximar do seu nucleo, estabelece-se uma ligação
electrostactica que aproxima os dois atomos.
Estrutura da agua
http://faculty.clintoncc.suny.edu/faculty/Michael.Gregory/files/Bio%20101/Bio%20101%20Lectures/Chemistry/chemistr.htm
Cortesia de Michael Gregory
cortesia de Anne Marie Bernier
cortesia de John Kimball
Estas ligações são comuns entre os dipolos, como as moléculas
de água, porque o átomo de oxigénio de uma molécula,
Estrutura da amonia
cortesia de Anne Marie Bernier
Estas ligações são
comuns entre os dipolos, como as moléculas de água, porque o átomo de
oxigénio de uma molécula, ligeiramente negativo, atrai átomos de
hidrogénio de outras moléculas, ligeiramente positivos .
Haverá sempre
um átomo dador e um átomo receptor de
pontes de hidrogénio
As ligações ponte de hidrogénio podem formar ainda ligações intramoleculares entre diferentes partes de uma mesma molécula,
permitindo a manutenção de uma estrutura tridimensional.
Animação sobre ligações ponte de hidrogénio
da agua
CAPITULO 4
QUIMICA DO CARBONO
A designação compostos organicos provem do vitalismo que afirmava
que só o organismo tinha a capacidade de sintetizar os seus proprios compostos
Desde que em 1828 WOEHLER com a síntese da ureia deu o primeiro passo
para a síntese de compostos orgânicos, se sabe que a síntese destes compostos
não é exclusiva do organismo.
Hoje considera-se que os compostos orgânicos são aqueles que contêm
carbono. Em oposição, os que não têm carbono designam-se por compostos inorgânicos. Todavia é costume
considerar inorgânicos alguns compostos simples do carbono como o anidrido
carbónico, carbonatos e cianetos.
Ligações envolvendo o carbono
A predominância do carbono nas
células vivas de modo que a sua presença define um composto como orgânico,
deve-se à capacidade única entre os
elementos de formar quatro ligações covalentes altamente estáveis.
Esta propriedade deve-se ao facto de ter apenas quatro electrões de
valência e portanto não tende para perder ou ganhar electrões em ligações
electrovalentes mas tende a partilhar os seus electrões para formar ligações
covalentes
Compostos carbonados
Classificação
Acíclicos
Não têm uma cadeia fechada, podendo ter uma cadeia linear ou ramificada
Cíclicos
Contêm uma cadeia fechada com
apenas átomos de carbono e hidrogénio.
Heterocíclicos
T|em uma cadeia fechada contêm para lá do carbono e hidrogénio, um outro
átomo( heteroátomo).
Saturação
Conforme os compostos não têm ou têm duplas ligações, os compostos
dividem-se em insaturados e saturados
CH3 –
CH2 – CH2 – CH3
Saturado
CH3 – CH = CH –
CH3
Insaturado
Saturados e
insaturados
Existência de
benzeno
Se o composto não tem um núcleo benzénico na sua estrutura, diz-se alifático.
Se tem, define-se como aromático
Estruturas simples, ramificadas
e cíclicas
O carbono forma ligações covalentes não só com átomos diferentes mas
tambem com ele próprio formando cadeias simples, ramificadas ou cíclicas Pode formar
ligações simples, duplas ou triplas
Graus de oxidação do carbono
É o numero de valências que o carbono
gasta em se combinar com o oxigénio ou
outros elementos electronegativos. Os graus de oxidação podem ir de 0 a 4
Graus de oxidação do carbono
Grau Composto
0
hidrocarbonetod
1
alcoois
2
aldeidos
3
acidos
4
ureia
Grupos funcionais
Considera-se que vários compostos pertencem à mesma família quando têm o mesmo
grupo funcional ou seja uma parte da molécula que lhes dá características
reaccionais comuns.
Toda a nomenclatura em química orgânica baseia-se nos grupos funcionais.
Para entender os grupos funcionais, é preciso, como veremos, compreender a química dos hidrocarbonetos.
CAPITULO 5
HIDROCARBONETOS
Definição
O carbono tem a capacidade de formar
quatro ligações covalentes
½
¾ C ¾
½
Quando as ligações envolvem apenas
carbonos e hidrogénios, formam-se hidrocarbonetos.
CH3
– CH2 …… CH2 – CH2 – CH2 – CH3
Hidrocarbonetos
Hidrocarbonetos
saturados e insaturados
CH3 – CH = CH – CH2 ……. COOH
Monoinsaturados
CH3 – CH = CH – CH2 – CH = CH –
CH2 – COOH
Poliinsaturados
Saturados e insaturados
Grupos funcionais
Graus de oxidação do carbono
É o numero de valências que o carbono
gasta em se combinar com o oxigénio ou
outros elementos electronegativos. Os graus de oxidação podem ir de 0 a 4
Graus de oxidação do carbono
Grau Composto
0
hidrocarbonetod
1
alcoois
2
aldeidos
3
acidos
4
ureia
Grupos funcionais
Considera-se que vários compostos pertencem à mesma família quando têm o mesmo
grupo funcional ou seja uma parte da molécula que lhes dá características
reaccionais comuns.
Toda a nomenclatura em química orgânica baseia-se nos grupos funcionais.
Para entender os grupos funcionais, é preciso, como veremos, compreender a química dos hidrocarbonetos.
CAPITULO 5
HIDROCARBONETOS
Definição
O carbono tem a capacidade de formar
quatro ligações covalentes
½
¾ C ¾
½
Quando as ligações envolvem apenas
carbonos e hidrogénios, formam-se hidrocarbonetos.
CH3
– CH2 …… CH2 – CH2 – CH2 – CH3
Hidrocarbonetos
Hidrocarbonetos
saturados e insaturados
CH3 – CH = CH – CH2 ……. COOH
Monoinsaturados
CH3 – CH = CH – CH2 – CH = CH –
CH2 – COOH
Poliinsaturados
Saturados e insaturados
Classificação
A ausência ou presença de um núcleo
benzénico divide os hidrocarbonetos em alifáticos e aromáticos.
A falta ou presença de ramificações
divide os hidrocarbonetos alifáticos em hidrocarbonetos da série n e
hidrocarbonetos ramificados
Hidrocarbonetos alifaticos
Numeração dos carbonos
Numeram-se a partir de uma das
extremidades.
Nos hidrocarbonetos as extremidades não
se distinguem, pelo que a numeração se pode iniciar por qualquer delas.
1
2 3 4 5
CH3 – CH2 – CH2 – CH2 – CH3
Ou
5 4 3 2 1
CH3 – CH2 – CH2 – CH2 – CH3
Numeração
Quando há carbonos oxidados, a numeração começa pelo carbono
mais próximo da extremidade mais oxidada.
Nomenclatura da série n
A nomenclatura construi-se usando um
prefixo para indicar o número de carbonos e um sufixo para indicar a natureza
das ligações.
Prefixos indicando o número de
carbonos
Número de carbonos
|
Prefixo
|
1
2
3
4
5
6
7
8
9
10
11
12
Indeterminado
|
Met
Et
Prop
But
Pent
Hex
Hept
Oct
Non
Dec
Undec
Dodec
……
Alc
|
Sufixos indicando a natureza das
ligações
Tipo
|
Sufixo
|
Nome genérico
|
Simples
Dupla
Tripla
|
Ano
eno
ino
|
Alcano
alqueno
alquino
|
Se há mais de uma dupla ou tripla ligação,
estas designam-se antepondo di ou tri à designação da natureza da ligação
Tipo
de ligações
.
Designação
|
Fórmula
|
Butano
Buteno
Butino
Butadieno
|
CH3 – CH2
– CH2 – CH3
CH3 – CH = CH
– CH3
CH3 – C º C – CH3
CH2 = CH – CH
= CH2
|
Radicais dos hidrocarbonetos
Quando um hidrogénio de um hidrocarboneto é substituído, forma-se
um radical chamado alquilo.
…... CH2
– CH2– CH3
hidrocarboneto
½
R
Alquilo
Alquilo
Os radicais
designam-se substituindo-se os sufixos dos hidrocarbonetos pelos sufixos
indicados no quadro seguinte
Radicais de hidrocarbonetos
Hidrocarboneto
|
Radical
|
Ano
|
ilo
|
Eno
|
enilo
|
Ino
|
inilo
|
Fórmulas
de radicais.
Radical
|
Hidisrocarboneto
|
CH2 –
CH3 etilo
CH2 = CH etenilo
CH º
C etinilo (ou vinilo)
|
CH3 –
CH3 etano
CH2 =
CH2 eteno
CH º CH etino
|
CH3 – CH2 –CH2-CH3
Carbonos – 4 but
Duplas ligações –
0 ano
Designação butano
CH3-CH2-CH—CH3
Carbonos – 4 but
Duplas ligações – 1
eno
Situação da dupla
ligação- 1
Designação – 1 buteno
CH3—CH-CH—CH2
Carbonos – 4 but
Duplas ligações
-2 dieno
Situação das duplas
ligações – 1,3
Designação – 1,3-butadieno
Exemplos de formulas de radicais
Construção da designação dos
hidrocarbonetos alifáticos
A designação será composta alinhando os
prefixos e sufixos estudados pela ordem seguinte:
1-
n
para indicar que pertence à série normal
2-
posição das
ligações
3- número de carbonos (met, et,
but...)
4 -número de duplas ligações
5-sufixo
indicando a natureza das ligações (ano,
eno, ino)
No caso de um hidrocarboneto não saturado, os pontos 2,4 e 5 não se
aplicam.
CH3 C2H5
½ ½
1CH3
¾ 2C ¾ 3CH2
¾ 4CH ¾ 5CH2
¾ 6CH3
½
CH2
Alcano mais longo
Ramificações
C2
C4
Designação
|
Hexano
2 metilos
1 etilo
2,2-dimetilo-4-etil-hexano
|
Nomenclatura
iso
Quando
a ramificação é um metilo no C2, pode-se fazer preceder o sufixo iso ao nome do hidrocarboneto correspondendo
ao numero total dos carbonos existentes
Nomenclatura isso
Bibliografia
Hidrocarbonetos
aromaticos
Definição
Definição
São
hidrocarbonetos contendo o nucleo benzenico
Dividem-se
em monociclicos e policiclicos conforme têm um ou mais nucleos
Benzeno
O benzeno é o 1,3,5 ciclohexatrieno.
É costume utilizar uma formula simplificada
Fórmulas
de Kekulé
Para Kekulé
o benzeno poderia ter qualquer das
fórmulas indicadas na figura seguinte
Ressonancia
ou mesomeria
As
formulas de Kekulé explicam-se admitindo que os electrões das duplas ligações
não estão fixos, mas oscilam entre duas estruturas possíveis
http://chemistry2.csudh.edu/rpendarvis/BenzStr.html
Diz-se
que uma molecula nestas condições ressoa e o fenomeno chama-se ressonancia ou mesomeria.
As duas
estruturas
- Satisfazem a regra do octeto
- Têm o mesmo numero de
ligações
- Têm o mesmo tipo de ligações
Bibliografia
http://ww.mhhe.com/physsci/chemistry/carey/student/olc/graphics/carey04oc/ref/ch11aromaticity.html
Classificação
¨
Derivados
monosubstituidos
¨
Derivados
bisubstituidos
¨
Hidrocarbonetos
policiclicos
Derivados
monosubstituídos
Coloca-se o substituinte como prefixo:
Metilbenzeno
Hidroxibenzeno
Aminobenzeno
Alguns derivados têm nomes triviais
Nomes triviais de derivados
monosubstituidos
Nomes
triviais
|
IUPAC
|
Tolueno
Fenol
Anisol
Anilina
Ácido
benzoico
Benzaldeido
Cianobenzeno
Estireno
Isobutilbenzeno
|
Metilbenzeno
Hidroxibenzeno
Metoxibenzeno
Aminobenzeno
Ácido
benzeno-carboxílico
Benzeno
carbaldeido
Benzonitrilo
Fenileteno
(ou vinilbenzeno)
1-fenol-2-metilpropano
|
Formulas
de derivados monosubstituidos
Derivados disubstituídos
Para os designar os substituintes são usados como prefixos. Quando os
substituintes são iguais, precede-se o nome do substituinte por di
Diclorobenzeno
1,4-clorobromobenzeno
No caso de substituintes iguais, usa-se
com frequência as designações orto
(o), meta(m) e
para(p) conforme a colocação das duplas ligações.
Nomenclatura
orto
Designação
|
Abreviatura
|
Substituintes
em
|
Orto
Meta
Para
|
O
m
p
|
1, 2
1, 3
1,4
|
Alguns
têm nomes triviais
Nomes
triviais de disubstituidos
Nome
trivial IUPAC
Xileno
1,2-dimetilbenzeno
m-toluidina 3-aminotolueno
p-cresol
4-hidroxitolueno
acido salicilico acido a-hidroxibenzoico
Hidrocarbonetos
policiclicos
¨ Têm
mais de um ciclo
Compostos de cadeia
fechada
Série
aliciclica
São hidrocarbonetos que fecharam a
cadeia.
Série isociclica
São compostos aromáticos apenas com
carbono e hidrogénio.
Correspondem aos hidrocarbonetos policiclicos
Cycloheptane
Série
heterociclica
Contêm, para lá do carbono e hidrogénio,
um outro átomo (heteroátomo)
Podem-se também designar utilizando um prefixo indicando a
natureza do heteroátomo
Designação do heteroátomo
Heteroátomo
|
Prefixo
|
Exemplo
|
N
N
S
|
Aza
Oxa
Tia
|
Azabenzeno (piridina)
1,3 – diazabenzeno
(pirimidina)
Oxaciclopentadieno
(furano)
Tiaciclopentadieno (tiofeno)
|
Compostos da série heterociclica
Exemplo de
hidrocarbonetos cíclicos
Alguns medicamentos têm esta estrutura
·
Antipiréticos –
acido acetilsalicilico
·
Antipiréticos –
Fenacetina, Acetomaminofeno
·
Esteróis como o
colesterol
·
Hormonas como as
genitais e as suprarenais
CAPITULO 6
EXEMPLOS DE HIDROCARBONETOS
Feromonas
Enquanto os homens colaboram pela fala e pela escrita os
animais comunicam pela secreção e detecção de moléculas chamadas feromonas
A maior parte das feromonas são especificas para a espécie
São derivadas de alcinos
Algumas têm uma estrutura relativamente simples como o
acetato de butilo das abelhas, outras têm estruturas mais complexas
Alcanos substituidos
Muitos
alcanos substituídos têm sido usados na
medicina e na indústria.
Um
derivado do etano, o etano-2.bromo-2-cloro-1,1,1-tricloroetano ou halotano é um anestésico.
O
cloreto de etilo
(cloroetano) é um anestésico local. É utilizado pelos atletas no decorrer das competições para suprimir dores locais.
O
tetracloreto de carbono
(tetraclorometano) foi usado como solvente na limpeza a seco tendo sido
substituído por outros compostos como 1,1,2,2,tetracloroeteno.
Os CCF (hidrocarbonetos clorofluoretados)
como o freon têm sido usados nos aparelhos de refrigeração e ar
condicionado e como propelente em aerosois, mas há tendência em abandoná-los
por lesarem a camada de ozono.
Os compostos com perfluorcarbono
têm capacidade de dissolver mais
oxigénio que o sangue.
Um destes compostos o fluosol – DA(perfluor decalina) em
solução aquosa, tem sido utilizado como
um substituto de curta duração do sangue
Uma outra aplicação dos compostos perfluorcarbonados é a sua
utilização nos computadores como liquido de arrefecimento para dissipar a
grande quantidade de calor produzida nos supercomputadores
Gás
O
gás natural é constituído por alcanos com menos de cinco
carbonos, principalmente o metano. É armazenado como líquido em tanques de alta
pressão.
O
gás metano com pequenas quantidades de etano é o constituinte do
gás natural transportado a longa distância a partir dos países produtores.
O
gás propano é fornecido em cilindros de baixa pressão (botijas)
aos locais que não dispõem de distribuição de gás natural.
Petróleo
O petróleo é obtido a partir de fosseis
As refinarias tiram partido dos diferentes pontos de
ebulição dos alcanos
Gases fervendo abaixo
de 20
Tem alcanos entre C1 e C5
Podem ser liquefeitos e vendidos como LPG (Liquefied Petroleum gás)
Entre 20 e 100
Alcanos entre C5 e C7
Constituem a nafta
É usada em solventes e em material para a industria química
Até 200
Tem alcanos entre C5 e C10
Tem poucas octanas
Pode reformular-se para produzir
gasolina comercial
Até 300
Contem alcanos entre C11 e C16
Fonte de queroseno e de gasolina
para jactos
Até 400
Contem alcanos com mais de C15
Usado como gasolina e diesel
Liquido remanescente
Contem hidrocarbonetos com mais
de C20
Fonte de lubrificantes
Resíduo solido
Usado para asfalto e parafina
Detergentes
São alquilbenzenos
Exemplos de compostos
aromaticos
Muitos
compostos aromáticos são usados para dar sabor ou aroma. É o caso do benzaldeido
das amendoas, do anetol do anis e da vanilina da
baunilha.
As
hormonas esteroides e o colesterol são
compostos aromáticos.
Há
medicamentos como a aspirina que contêm este núcleo.
CAPITULO
7
Grupos
funcionais
Conjunto de elementos que apresentam
propriedades físicas e química bem definidas quando ligados a cadeias
carbonadas.
Álcoois
Definição
Hidroxilo ligado a um grupo carbonado
saturado (carbinol)
½
OH ¾ C ¾
½
Tambem se podem definir como a substituição
de um hidrogénio da água por um grupo carbonilo.
A sua fórmula geral é portanto R-OH
Classificação
O OH pode estar ligado a um carbono
primário, secundário ou terciário e assim o álcool denominar-se-á primário,
secundário ou terciário.
Também poderemos considerar que estas
categorias dependem do número de radicais ligados ao carbono
http://ull.chemistry.uakron.edu/genobc/Chapter_13/
Cortesia de James Hardy
Classificação
dos álcoois
|
½
|
|
Nomenclatura
Segundo a IUPAC um álcool designa-se
acrescentando ol ao hidrocarboneto donde
deriva.
Geralmente designam-se fazendo seguir à
palavra álcool o radical com o sufixo ico
CH3OH
Alquilo – metilo
Sufixo – ico
Designação – álcool
metílico
CH3OH
hidrocarboneto – metano
Sufixo – ol
Designação – metanol
Nomes triviais de alguns álcoois
Alguns
álcoois têm nomes triviais
Nomes triviais de
alguns álcoois
Designação IUPAC
|
Nome comum
|
Metanol
Etanol
1-propanol
2- propanol
Etanodiol
Propanotriol
1-pentanol
1-Propeno-3-ol
Fenilmetanol
|
Álcool metilico
Álcool etilico
Álcool n-propilico
Álcool isopropilico
Etilenoglicol
Glicerol
Álcool amilico
Álcool alilico
Álcool benzilico
|
Fenóis
Álcoois derivados de hidrocarbonetos
aromáticos
cortesia
de James Hardy
Fenóis
Designam-se fazendo preceder
à palavra benzeno o nome do radical
Muitos fenóis têm nomes triviais
Nomes triviais de alguns fenois
Designação IUPAC
|
Nome comum
|
Hidroxibenzeno
Hidroxitolueno
1,3 – dihidroxibenzeno
1,4 – dihidroxibenzeno
2-hidroxinaftaleno
|
Fenol
o-cresol
Resorcinol
Hidroquinona
b-naftol
|
Isómeros
Quando há isómeros possíveis, o número do
carbono em que está o OH deve preceder o sufixo ol
CH3–CH2–CH2–OH
BUTANO
|
CH3–CH–CH2
½
OH
PROPANO
-2- OL
|
Designação dos isómeros
|
Se há cadeias laterais, o nome destas
aparece como prefixo
Polialcoois
Um hidrocarboneto pode ser substituído por mais de um oxidrilo – polialcoois ou poliois
Designam-se com os sufixos diol, triol, etc., conforme o número de
oxidrilos existentes.
Deve-se tambem referir o numero dos carbonos em que se encontram
os oxidrilos
Enois
O oxidrilo está ligado a um carbono com uma dupla ligação
Tiois ou mercaptans
São análogos do álcool (análogos são compostos
que diferem apenas num elemento).
O O
do OH está substituído por um S
R
– OH R-SH
Álcool Tiol
R-CH2OH
Álcool
R-CH2SH
Mercaptan
|
Tiois
Nomenclatura
Designam-se fazendo seguir tiol ao
nome do hidrocarboneto ou fazendo seguir ao alquilo a palavra mercaptan
CH3
– CH2 – SH
Etanotiol
Etilmercaptan
CH3 – CH2 – SH
|
|
Hidrocarboneto
Sufixo
Designação
|
: etano
: tiol
:
etanotiol
|
ou em alternativa
Alquilo
Sufixo
Designação
|
: etilo
:
mercaptan
:
etilmercaptan
Nomenclatura dos tiois
|
Eteres
Definição
Resultam da condensação de dois álcoois
com perda de água.
São dois grupos alquilo ligados por um oxigénio
correspondendo à ormula geral: R-O-R’
Nomenclatura
Segundo a IUPAC designam-se precedendo o
hidrocarboneto do alquilo seguido de oxi
cortesia de James Hardy
Designação dos eteres
Os éteres designam-se muitas vezes pelo
nome comum, construído por analogia com os álcoois - éter etílico
CH3 – O – CH3
Éter dimetilico
CH3-CH2- O -
CH3
Éter dimetilico
Nomes comuns de eteres
Aminas
Definição
São derivados do amoníaco por
substituição
O carbono ligado á amina não tem duplas
ligações
Classificação
Dividem-se em primárias, secundárias e terciárias conforme o
número de substituintes.
Estas substituições foram feitas num
azoto trivalente.
Se forem feitas num azoto pentavalente
(como é o caso da OH-NH4)
forma-se uma amina quaternária.
Tipos
de aminas
Dividem-se
em alifaticas e ciclicas
As cíclicas dividem-se em aromaticas e
heterociclicas
Nomenclatura
Segundo a
IUPAC antecede-se o hidrocarboneto da palavra amina
CH3NH2
Metilamina
(CH3)2 NH
Dimetilamina
CH2NHCH2CH3
Metiletilamina
cortesia de James
Hardy
Nomenclatura
IUPAC para as aminas
Na designação trivial acrescenta-se ao
alquilo ou ao radical aromático o sufixo
amina.
CH3NH2
Metilamina
(CH3)2 NH
Dimetilamina
CH2NHCH2CH3
Metiletilamina
cortesia de James
Hardy
Designações
triviais das aminas
A maior parte das aminas aromaticas e
heterociclicas têm nomes triviais
88 fig. IX.18
Aminas
aromáticas e heterociclicas
cortesia de James
Hardy
Aromatic amine
|
Properties
|
Uses
|
||
62-53-3
|
||||
95-53-4
|
||||
88-05-1
|
cortesia de James
Hardy
Nomes
triviais de algumas iminas heterocíclicas
Nomes triviais de aminas aromaticas
Quando uma amina primária coexiste com
outros grupos funcionais, ela é tratada como um substituinte
cortesia de James
Hardy
Amina coexistindo com outros grupos funcionais
Iminas
Definição
O NH está ligado a um alquilo por uma
dupla ligação
http://en.wikipedia.org/wiki/Imine
Resultam
da substituição de dois hidrogénios de um hidrocarboneto por um N
CH3
– CH2 – CH3
Hidrocarboneto
CH3
– CH2 – CH = NH
Imina
Substituição de dois hidrogenios
Nomenclatura
Designam-se acrescentando o sufixo imina ao hidrocarboneto
CH3 – CH2 – CH = NH
Propanoimina
Carbonilo
É um carbono ligado ao oxigénio por uma dupla
ligação
Carbonilo
Os compostos contendo carbonilos são
- Aldeidos
- Cetonas
- Ácidos
carboxilicos
- Anidridos
de acido
- Esteres
- Amidas
cortesia de James Hardy
Compostos contendo o grupo carbonilo
Aldeidos
Formula
Resultam da desidrogenação de um alcool
Também se podem considerar resultantes da
substituição de dois hidrogénios do CH3 de um hidrocarboneto por um
oxigénio
A sua fórmula geral é R-CHO
Formula geral dos aldeidos
Nomenclatura
Segundo a IUPAC designam-se pelo sufixo al
Tambem se
podem designar pela palavra aldeido seguida do adjectivo do alquilo
CH3CH2CHO
IUPAC propanal
Comum aldeido propilico
Designações
dos aldeidos
Cetonas
Formação
Resultam da substituição num carbono
secundário de dois hidrogénios por um oxigénio
Formula
geral das cetonas
Nomenclatura
Segundo a IUPAC designam-se pelo
sufixo ona
H3C-CO-CH3
Propanona
Diferença
entre aldeidos e cetonas
Diferem na localização do C=O – carbono terminal nos
aldeidos e carbono secundário nas cetonas
Quinonas
http://en.wikipedia.org/wiki/Quinone
Ácidos
carboxilicos
Formula
Resultam da substituição num
hidrocarboneto de um metilo terminal por um carboxilo
R-CH2-CH3
Hidrocarboneto
R-CH2-COOH
Àcido carboxílico
Acidos
carboxilicos
Nomenclatura
Segundo a IUPAC designam-se pelo sufixo oico
CH3-CH2-COOH
Ácido propanoico
cortesia de James Hardy
Nomenclatura
dos ácidos carboxilicos
Em geral
os acidos aromaticos designam-se como derivados do benzeno
Nomes triviais
cortesia de James
Hardy
Anidridos de acido
Formação
Condensação
de dois acidos carboxilicos com perda de água
cortesia de James Hardy
Formação
dos anidridos de acido
Formula geral dos anidridos de
acido
Nomenclatura
Designam-se
substituindo a palavra ácido por anidrido
cortesia de James
Hardy
Designação dos anidridos de acido
Esteres
Formação
Resultam da combinação de um ácido carboxílico com um álcool com perda
de água, o que equivale a dizer que o grupo –OH de um acido carboxilico é
substituido por um grupo –OR
Nomenclatura
.
Designam-se como se fossem sais
A cadeia mais longa designa o acido
CH3 – CH2 – CO – O –
CH2 – CH3
Propionato etilo
Propionato
de etilo
Cortesia de James Hardy
|
Tioesteres
Resultam
da reacção de um acido com um tiol
Lactonas
É a ciclização de uma molécula pela
combinação interna de uma função álcool com uma função ácido – são esteres
internos
Encontram-se anéis de três membros (alfa-lactonas),
quatro (beta), cinco (gama) e seis (delta)
Amidas
Formação
Resultam da reacção de um ácido carboxílico
com uma amina, levando à substituição de um OH por um NH2
R-COOH + R’-NH2 ¾® R-CO - R’-NH2
Ácido
carboxilico Amida
|
Formação de uma amida
Nomenclatura
Designam-se acrescentando o sufixo amida
ao hidrocarboneto
CH3-CH2-CONH2
Propanoamida
cortesia de James
Hardy
Designação
das amidas
Lactamas
São amidas cíclicas, resultantes da
desidratação intramolecular de um aminoácido
http://fr.wikipedia.org/wiki/Lactame
Structure générale de β-lactame, γ-lactame,
δ-lactame et ε-lactame.
Semiacetais
Formação
Resultam da reacção de um aldeido ou de uma cetona com um
álcool
Nomenclatura
Designam-se
antepondo o prefixo alcoxi ao álcool
Semiacetais internos
Designam-se pelo prefixo epoxi
Acetais e cetais
Os acetais resultam da reacção de um aldeido com duas
moléculas de álcool.
Os cetais resultam da reacção
de uma cetona com duas moléculas de água.
Denominam-se antepondo o nome dos
radicais aos hidrocarbonetos
Acetais
cetais
Compostos com carbono de grau de oxidação 4
Compostos com carbono de grau de oxidação 4
Neste caso o carbono tem todas as suas valências saturadas,
não sepodendo combinar com outros átomos
São exemplos a guanidina e a ureia
Ureia
Capitulo 8
GRUPOS FUNCIONAIS E MOLECULAS DE
INTERESSE
Álcoois
Metanol
É também conhecido por álcool da madeira porque antes era
produzido pela destilação destrutiva da madeira
Hoje produzem-se biliões de litros em instalações
industriais
É tóxico para o homem
É utilizado para a produção de formaldeido, necessário para
a síntese de plásticos
Álcool etílico
Bebidas alcoólicas
O álcool resulta da fermentação de glucidos existentes numa
grande variedade de vegetais
O sabor das bebidas não é dado pelo álcool, que não tem
gosto, mas da fermentação de matéria vegetal
Combustivel
O álcool pode ser usado como combustível
Misturado com produtos do petróleo aumenta as octanas da
gasolina, não sendo necessário acrescentar chumbo
Alcool isopropilico
É utilizado como solvente em produtos de cosmética e outros
aplicados externamente
Etilenoglicol
Devido ao seu baixo ponto de congelação ( - 12) é o
componente principal dos anti-congelantes para automóveis
Glicerol
É um constituinte dos lipidos
Não é tóxico
A sua falta de toxicidade e a sua forte hidrofilia, explica
o seu uso como aditivo alimentar para manter os alimentos frescos por retenção
da humidade
A sua combinação com o acido azótico produz a
nitroglicerina, explosivo poderoso, constituinte da dinamite
A nitroglicerina é também um
vasodilatador, utilizado no tratamento da angina pectoris
Fenóis
O hexilresorcinol é utilizado como desinfectante nos
elixires dentários
O polifenol tetrahidrocanabinol é o constituinte da canabis
ou marijuana
Cheiro dos tiois
Os tiois têm cheiro e sabor
desagradáveis. Esta propriedade é utilizada na indústria do gás. Como o gás não
tem cheiro, acrescentam-se pequenas quantidades de etanotiol para que este com
o seu cheiro alerte para fugas de gás
Éteres
Éter como anestésico
Antes de 1850 poucos doentes sobreviviam à cirurgia devido
ao shock produzido pela dor e às infecções
A introdução da anestesia pelo éter por MORTON em 1850
alterou estas perspectivas, complementada pela introdução por LISTER em 1865 do
fenol como desinfectante.
O éter é inflamável e explosivo pelo que implica cuidados
especiais no seu manejo
Por outro lado, provoca reacções colaterais incomodas para
os doentes
Surgiram depois vários éteres halogenados como o fluotano
com menos inconvenientes
Hoje os éteres já não são utilizados como anestésicos
Aminas e amidas
Alcalóides
Muitas plantas são ricas em aminas, englobadas no grupo dos
alcalóides
Muitos alcalóides eram utilizados pelos feiticeiros das
tribos primitivas para fins terapêuticos
A industria aproveitou este conhecimento para isolar
espécies químicas activas
Coniina
É o principio activo da cicuta, consumida por Sócrates para
se suicidar
Cocaína
É extraída das folhas de coca, que cresce nas montanhas dos
Andes
Em pequenas quantidades é estimulante e analgésico mas o seu
uso continuado leva à adição
Substitutos sintéticos são usados como anestésicos locais
como a procaina (novocaina) em medicina dentaria e a benzocaina nas queimaduras
solares.
Alcalóides do ópio
São produtos obtidos a partir das sementes da Papaver
somnifera
São analgésicos e hipnóticos
Induzem euforia que leva
à adição
Morfina
E o principal alcalóide do ópio, isolado nos princípios do
século XIX
A descoberta da seringa hipodérmica permitiu o seu uso em
grande escala na Guerra Civil Americana
Codeína
É o éter monometilico da morfina
É menos potente e menos aditiva que a morfina
Heroína
Foi sintetizada em 1890
pela reacção da morfina com o anidrido acético que converte os grupos OH
em acetato
Produz um efeito euforizante mais forte e é altamente aditiva
Produtos sintéticos
Devido aos efeitos analgésico destes compostos procurou-se
sintetizar compostos sem ou com poucos efeitos aditivos
Têm todos o esqueleto básico da morfina
Exemplos destes compostos são o Darvon e o Demerol
Outros alcalóides
A quinina, primeiro antimalarico conhecido, foi obtida a
partir da arvore de chinchona
A reserpina, tranquilisante e anti-hipertensivo, foi obtida das raízes da Rawolfia serpentina.
Derivados da
2-feniletilamina
A adrenalina e a nor-adrenalina são moleculas biológicas com esta estrutura
A efedrina, extraída
inicialmente da planta chinesa ma-huang, é usada como descongestionante
nasal
As anfetaminas, como a benzedrina, são estimulantes do
sistema nervoso central
A mescalina é um alucinogenio existente no peyote
Alguns derivados da feniletilamina, como a serotonina e a
dopamina, são neurotransmissores
Sais de amónio
A acetilcolina é um neurotransmissor
Quando a aceticolina atinge o receptor é hidrolisada em colina pela acção da
acetilcolina esterase
Alguns sais de amónio quaternário são inibidores
competitivos da acetilcolina esterase
Esta propriedade justifica o emprego em cirurgia de alguns
sais de amónio quaternário como o brometo de decametonio e o brometo de
sucinilcolina, como relaxantes musculares
Um outro sal de amónio , a tubocurarina é o componente
activo do curare, existente nalgumas plantas da América do Sul, utilizado por
algumas tribus para paralisar a caça
O curare também foi utilizado em cirurgia mas foi
rapidamente abandonado por ser extremamente potente, podendo levar ``a morte
por paralisia dos músculos respiratorios
Sulfonamidas
As sulfonamidas resultam da sulfonação de aminas por
cloretos sulfonilados aromáticos
O composto donde todas derivam é a sulfonamida
Como é tóxica, usam-se derivados
O sulfatiazol salvou muitas vidas na II Guerra Mundial, a
sulfapiridina foi o primeiro tratamento
eficaz das pneumonias e a sulfadiazina é largamente utilizada no tratamento
de muitas infecções.
As sulfonamidas actuam devido à sua semelhança com o acido
paraminobenzoico (PABA) necessário para a síntese do acido folico
Como o acido folico é necessário para o crescimento bacteriano,
este crescimento não se faz na presença destes compostos
As sulfonamidas não actuam sobre o organismo humano, porque
este não sintetiza o acido folico
Ácidos carboxilicos
Ácidos carboxilicos
na natureza
O vinagre é uma solução diluída de acido acético (acido
etanoico) proveniente da oxidação do etanol do vinho
O cheiro e sabor do queijo
deve-se ao acido propiónico (acido propanoico)
O ranço deve-se à
presença de acido butirico
O acido cítrico é responsável pela acidez dos frutos
citrinos como o limão
Medicamentos
A aspirina é o acido acetilsalicilico
O ibuprofen e o naproxen também têm na sua composição ácidos
carboxilicos
Lactonas
O
ácido ascórbico ou vitamina C
é o exemplo de uma lactona
existente na natureza.
O
dicumarol é uma lactona com propriedades anticoagulantes.
Os
macrolidos são lactonas com muitos ciclos. Alguns macrolidos são
antibióticos.
A
mevastatina, metabólito isolado de um tipo de fungos, inibe a
síntese do colesterol, tendo sido o ponto de partida para uma série de fármacos
com o nome genérico de estatinas, que baixam o colesterol do
sangue.
Lactamas
A
penicilina é uma lactama
ligada a um anel tiazólico. Foi descoberta em 1928 por Sir ALEXANDER FLEMING
ao estudar o fungo Penicilium notatum
As
cefalosporinas são uma família mais recente de antibióticos
lactamicos, isolados também a partir de fungos.
As
lactamas impedem a síntese das peptidoglicanas, necessárias para a síntese da
parede das bactérias, tendo nelas um efeito letal porque a membrana deixa de
proteger a bactéria da acção dos meioshipotonicos que a rodeiam
Capitulo
9
ISOMERIAS
Definição
Isómeros são
compostos com a mesma fórmula empírica nas com fórmulas moleculares diferentes.
Isomeria de cadeia
Os compostos
diferem entre si por uma estrutura diferente da cadeia carbonada
Isomeria de posição
Os compostos diferem pela posição dos grupos funcionais ou
das duplas ligações
CH3 – CH2
– CH2 – CH2OH
1-butanol
CH3 – CH2 – CH OH – CH3
2-butanol
Posição dos grupos funcionais
CH3 – CH2 – CH = CH2
1-butano
CH3
– CH = CH – CH3
2-butano
Posição das duplas ligações
Isomeria por compensação
São isómeros
com grupos funcionais diferentes
Isomeria cis-trans
Depende da orientação dos radicais à volta do eixo das duplas ligações.
Se os radicais estão do mesmo lado, os compostos designam-se por cis
e se estão em lados diferentes designam-se por trans
Estereoisomeros
Quiralidade
Nalguns objectos as
imagens em espelho não são sobreponíveis.
Imagens em espelho não sobreponiveis
É o caso de uma
chávena ou de um garfo.
Noutros casos os pares de objectos não são
sobreponíveis a não ser que um deles rode
É o que se passa
entre a mão direita e a mão esquerda – as duas mãos não se sobrepõem, tendo que
se rodar uma delas para se fazer a sobreposição do mesmo modo a luva direita
não entra na mão esquerda
.
Imagens sobrepoem-se após rotação de um
dos objectos
Do mesmo modo a luva direita não se sobrepõe à
mão esquerda
.Os pares que não
se sobrepõem dizem-se quirais e
esta característica designa-se por quiralidade.
A quiralidade tem a ver com a
ausência de um plano de simetria. Se observarmos uma luva é fácil de constatar
que a sua metade direita não é igual à esquerda, a não ser que rode.
Pelo contrário, as
meias têm um plano de simetria e por esta razão uma meia entra em qualquer dos
pés.
Quere dizer, as
luvas por não terem plano de simetria não se sobrepõem, são quirais. As
meias não têm plano de simetria, sobrepõem-se, são aquirais.
.
Animação:
Carbonos assimétricos
O carbono tem a capacidade de formar quatro ligações
covalentes
Estas ligações podem-se representar num modelo de bolas e
hastes
Pode-se considerar que os compostos tomam a forma de um
tetraedro em que o núcleo do carbono
está no centro e as quatro ligações covalentes se dirigem para os vértices
Quando os quatro radicais que se ligam ao carbono são
diferentes diz-se tratar de um carbono
assimétrico.
Enantiómeros
Cada carbono assimétrico pode-se arranjar no
espaço de modo a formar dois compostos diferentes que são quirais, isto é, não
se sobrepõem.
Estes isómeros
dizem-se enantiómeros .
http://www.chemhelper.com/enantiomers.html
Formulas de projecção
Como é difícil
escrever fórmulas em tetraedro, FISCHER idealizou as formulas de projecção em
que os quatro radicais estão projectados num só plano
Formulas de projecção
As ligações situadas atrás do plano da página
estão a ponteado e as situadas no plano estão a cheio
Diestereoisómeros
Quando os compostos têm dois carbonos assimétricos,
haverá quatro estereoisómeros
Nestes casos há pares de enantiómeros. O númerto total de
isómeros possíveis é dado pela fórmula 2n2 em que n é o número de
carbonos assimétricos.
Diestereoisomeros
Actividade óptica
Luz polarizada
Quando um feixe de luz monocromática atravessa um prisma de calcite,
este cinde-se em dois componentes o raio ordinário que segue as leis da
refracção e o raio extraordinário ou polarizado que não é refractado
normalmente e é perpendicular ao anterior
http://www.blogger.com/blogger.g?blogID=4610414148984125511#editor/target=post;postID=1624065110714402767;onPublishedMenu=allposts;onClosedMenu=allposts;postNum=2;src=link
No prisma de Nicol o raio ordinário é eliminado, sendo transmitido
apenas o polarizado
Polarimetro
Desvio da luz polarizada
´
Quando um feixe de
luz polarizada atravessa uma solução, as moléculas nela dissolvidas podem
desviar ou não o plano de polarização da luz.
Quando desviam a
solução diz-se opticamente activa,
podendo a substância ser dextrógira se desvia para a
direita e levógira se
desvia para a esquerda.
O desvio do plano
de polarização da luz é feito pelo polarimetro
cortesia de Thomas Nexton
A natureza e
intensidade do desvio são características moléculares. O desvio do plano de
polarização indica a presença de um carbono assimétrico
Quando uma
substancia é constituída por partes iguais de formas d- e l- da mesma molécula,
a substancia diz-se racemica.
Como os desvios se
anulam, a substancia é opticamente inactiva
.
Compostos meso
São compostos com carbonos assimétricos mas que são
opticamente inactivos porque as suas duas metades se sobrepõem
Acido mesotartarico
CAPITULO11
IMPORTANCIA BIOLOGICA DAS ISOMERIAS
Isomeria cis-trans e visão
·
Nos
cones e bastonetes da retina encontra-se
a rodopsina constituída por uma proteína, a opsina e pelo cis-retinal.
A
conformação do cis-retinal é tal que se
adapta numa “cavidade” da opsina. Pela acção da luz o cis-.retinal
transforma-se no isómero trans que
já não se encaixa na opsina e dissocia-se dela. Esta dissociação desencadeia um
impulso eléctrico que é captado pelo nervo óptico e transmitido ao cérebro
Descoberta dos
enantiomeros
A descoberta dos enantiómeros deve-se a PASTEUR.
Em 1848 ao estudar o ácido tartárico do vinho, PASTEUR observou a existência de duas formas, uma que era dextrogira e outra
que não desviava a luz. A esta ultima forma
Pasteur deu o nome de ácido racemico (de racemus = uva).
Observando ao microscópio o acido racémico, Pasteur constatou que era uma mistura de uma
forma dextrógira e de uma levógira.
Pasteur
ignorava a razão da existência da actividade óptica pois a noção de carbono
assimétrico só surgiu em 1874.
O seu génio permitiu intuir esta realidade só mais
tarde explicada. É curioso referir que o nome racémico por ele introduzido, é
hoje utilizado para exprimir a mistura em partes iguais de dois enantiomeros,
que por esta razão são opticamente inactivos.
Interesse biológico dos enantiomeros
A
importância biológica dos enantiómeros resulta do facto de os enzimas poderem
distinguir as suas duas formas
A talidomida foi um medicamento tornado célebre por
provocar deformações fetais consequência da sua administração a grávidas para
combater o enjoo. A fórmula administrada era a mistura dos dois isómeros, dos
quais um é responsável pelas lesões.
A DOPA (dihidroxifenialanina) é usada no tratamento
da doença de Parkinson. Inicialmente administrou-se a forma racémica que tinha
acções colaterais. Actualmente conseguiu-se isolar o isómero activo a forma l,
conhecido como levodopa, que não tem acções colaterais.
Capitulo 12
ESPAÇO E TEMPO
Todos os
fenómenos biológicos se desenvolvem no espaço e no tempo.
A sua escala de grandeza obriga a
utilizar unidades de medida apropriadas.
Espaço
As unidades de medida mais utilizadas são
o Angstrom (Aº) correspondendo a 10-10
metros ou 0,1 nanometros (nm) e os micrómetros (m)
correspondendo a 104 Aº.
Em princípio, usa-se o Aº para valores inferiores a 100 Aº
e o um para dimensões maiores.
Algumas
dimensões
Exemplo
|
Dimensão
em Aº
|
Ligação
C-C
Hemoglobina
Ribosomas
Vírus
Eritrocitos
|
1,5
65
300
100-1000
7 x 104
|
O limite de
resolução do microscópio óptico é de
2000 Aº, o que corresponde às dimensões da maioria dos organelos
intracelulares.
As estruturas
moleculares estão abaixo deste limite de resolução, sendo utilizados para o seu
estudo a microscopia electrónica e a cristalografia de raios X.
Tempo
O tempo em que
se passam os fenómeno biológicos é extremamente curto.
As unidades de tempo utilizadas são o milisegundo(ms) correspondendo a l0 –3 segundos e o microsegundo(us) correspondendo a 10 –6. Numa escala menor temos
ainda o nanosegundo (ns) correspondendo a 10 –6 e o picosegundo (ps) correspondendo
a 1o –9.
Tempo
de alguns fenómenos biológicos
Fenómeno
|
Tempo
|
Reacções enzimáticas
Despregueamento da dupla cadeia do DNA
Interacções covalentes
Rotação de um domínio proteico sobre outro
Absorção de um fotão na visão
|
ms a us
1 us
« 1 us
ns
ps
|
CAPITULO
13
ESTRUTURA
DA AGUA
Ligações
covalentes
A molécula de água está constituída pela ligação de dois átomos de hidrogénio a um de oxigénio
por uma ligação covalente.
O hidrogénio pode formar
ligações covalentes com outros átomos como seja com o carbono (CH4), azoto (NH3) e flúor (FH). Também se pode unir com um
átomo do mesmo grupo da tabela periódica, o enxofre, para formar ácido
sulfídrico (SH3). Uma característica peculiar da água é de à
temperatura ambiente se encontrar no
estado líquido, ao contrário das moléculas atrás citadas formadas pela ligação
covalente com outros átomos.
A explicação destas
características diferentes deve-se à natureza das ligações entre o carbono e o
oxigénio, que iremos estudar a seguir.
Água,
molécula polar
A agua é um dipolo porque a água não se dispõe
linearmente mas sim de um modo angular
Cortesia
de Martin Chaplin
London
South Bank University
Disposição angular da agua
A água é portanto uma molécula
assimétrica ao contrário das outras hidrogenadas citadas, que são simétricas.
Devido a esta disposição
espacial, os centros de gravidade das cargas eléctricas positiva e negativa não
coincidem e a água torna-se um dipolo.
Ligações ponte de hidrogénio
A água tem capacidade de formar
ligações ponte de hidrogénio com outras moléculas de água e com outras
moléculas
Cortesia
de Martin Chaplin
London
South Bank University
Ligações ponte de hidrogenio na agua
A ligação ponte de hidrogénio é
o resultado de um equilíbrio de forças. A ligação será fraca se a ligação
covalente não estiver suficientemente polarizada para formar um dipolo ou se a
carga negativa não for forte. A geometria da molécula de água está
magnificamente apropriada para este tipo de ligação.
Associação das
moléculas de agua
Só no estado de vapor existem
moléculas de água isoladas. Nos estados líquido e sólidos existem polímeros da
água correspondendo à fórmula geral (H2O)n
Cortesia
de Martin Chaplin
London
South Bank University
Associação de moleculas de agua
No caso da água a formação
destas ligações é de natureza cooperativa pois que a formação de uma ligação
facilita a formação das seguintes. Por outro lado, quando uma ligação se
desfaz, as outras desfazem-se mais facilmente.
Agua liquida e gelo
A água é o único líquido em que
a sua forma sólida é menos densa que a líquida. Esta diferença explica-se pela
diferente geometria molecular da água e do gelo.
Estrutura do gelo
O gelo tem uma estrutura
cristalina regular em que foram feitas todas as ligações ponte de hidrogénio
possíveis.
No gelo cada molécula de água está rodeada por quatro moléculas de água ligadas por ligações ponte de hidrogénio formando uma
estrutura hexagonal
Esta estrutura aberta permite a
sua expansão em vez da condensação.
Embora na fusão do gelo algumas
ligações ponte de hidrogénio sejam destruídas muitas ligações permanecem na
água líquida. O calor de sublimação do
gelo a 0º é de 46,9kJ/mol dos quais apenas 6
são atribuídos à energia cinética
das moléculas gasosas. As outras 41 representam a energia requerida para
desfazer as pontes de hidrogénio.
O calor de fusão do gelo
(6kJ/mol) é 15% da energia necessária
para romper a estrutura do gelo, o que significa que a água líquida tem menos
15% de ligações ponte de hidrogénio que o gelo.
Estrutura da água
Na água líquida, as ligações
ponte de hidrogénio estão distorcidas de modo que as moléculas formam uma rede
variada e irregular. Cada molécula de água faz ligações ponte de hidrogénio com
quatro vizinhas ao contrário da água que faz apenas 3,1. Os anéis de moléculas de água ligada são constituídos de 4 a 7 moléculas ao
contrário das 6 do gelo o que lhe dá uma configuração hexagonal. Na água esta
rede está-se continuamente destruindo e
reformulando pois que cada molécula de água reorienta a sua estrutura cada
10–12 seg. Podemos concluir que as
moléculas de água consistem numa rede
ligada por pontes de hidrogénio em constante reorientação com uma
estrutura que de quando em quando é semelhante à do gelo.
Quer dizer, enquanto o gelo tem
uma estrutura altamente ordenada, a da
água é irregular estando os
agregados de moléculas ligados por pontes de hidrogénio a se cindirem e a se reformularem
constantemente
Consequências da densidade baixa do gelo
O facto de o gelo ser menos
denso que a água cria condições para tornar a vida possível. Se o gelo fosse
mais denso, este mergulharia até ao fundo dos oceanos e lagos e impediria a
vida nos mares pois que com o gelo a flutuar, é possível a vida nas camadas de
água que existem debaixo do gelo. Por outro lado, o gelo não derreteria com o
calor o que, associado aos efeitos da reflexão da luz do sol sobre estas
superfícies geladas, implicaria que a terra tivesse temperaturas muito mais
frias, vivendo-se numa idade do gelo permanente.
Capitulo 14
PROPRIEDADES FISICOQUIMICAS DA AGUA
Densidade
À pressão atmosférica a densidade da água
aumenta à medida que a temperatura
desce, a densidade sobe até atingir os
4º, temperatura a que a densidade tem o seu valor mais alto (1,000) e a partir
daí começa a descer
Tensão
superficial
A água tem uma tensão superficial mais
elevada que a dos outros líquidos, o que se explica pela forte união das
moléculas devido às pontes de hidrogénio.
Propriedades
termicas
Estas propriedades conferem-lhe um papel
fundamental na regulação da temperatura na terra e nos organismos vivos.
Calor
específico
É a quantidade de calor necessária para
subir de 1º uma substância sem que esta
mude de estado. O calor específico da água é de 1.
O calor especifico da água é o mais
elevado dos sólidos e líquidos conhecidos, exceptuando o amoníaco. Por
consequência, comparando com outro líquido, é necessário mais calor para
aumentar a sua temperatura e esta quando arrefece liberta menos calor. Esta
propriedade explica-se por grande parte da energia administrada ser gasta a destruir as ligações
ponte de hidrogénio.
Consequências
do calor especifico elevado
Durante as horas de muito calor a água do mar e o vapor de
água ambiente absorvem grande quantidade de calor que devolverão quando a
temperatura ambiente descer. É esta razão da maior constância e benignidade do
clima marítimo em relação ao continental.
O calor especifico da água também
protegem o organismo do calor formado no organismo no decorrer das suas
actividades metabólicas. O homem produz cerca de 3000 calorias por dia. Se não
fosse este papel protector da água, a temperatura do corpo atingiria os
100-150º.
Condutividade
térmica
O calor propaga-se por condução quando
entram em contacto duas partes com temperatura diferente. A facilidade em
transportar o calor exprime-se na condutividade calórica.
Os melhores condutores de calor são ao
metais. A água tem uma condutividade calórica muito inferior ao dos metais mas
muito superior à dos outros líquidos.
Devido a esta propriedade, a água impede
aumentos localizados de temperatura em zonas de intensa actividade metabólica e
permite que todas uma temperatura constante.
Calor de
vaporização
Já foi estudado
Constante
dielectrica
A constante dielectrica indica a capacidade
de uma substância em diminuir a intensidade de um campo eléctrico. A água é dos compostos com uma constante
dielectrica mais elevada (81). Este valor 81 significa que cargas eléctricas de
sinal contrário exercem na água uma atracção 81 vezes menor que no ar ou no
vácuo. Quando se introduz um cristal como por exemplo o cloreto de sódio, as
forças electrostáticas, causa da ligação
iónica, diminuem 81 vezes e assim os iões deixarão de se existir passando a
existir dissociados como Cl- e Na+.
Transparencia
A transparência da água permite que os
cloroplastos das células vegetais possam absorver a energia solar necessária
para a fotosíntese e que a vida vegetal se possa desenvolver debaixo da
superfície da água
Agua
como meio de dispersão
A água pode destruir a coesão molecular
de muitos compostos, favorecendo a dispersão ou dissolução de muitas
substâncias.
Hidratação
molecular
Os dipolos da água podem-se associar com
grupos polares existentes noutras moléculas.
Quanto maior o número de grupos polares
maior é a atracção recíproca entre uma molécula e a água. Denomina-se hidrofilia
à tendência de um composto em se
rodear de moléculas de água.
A água adere fortemente às superfícies
polares. No caso das proteínas a camada de água de hidratação pode representar
30% do seu peso seco.
A hidratação molecular contribui para a
orientação espacial de macromoléculas, em especial das proteínas.
Hidratação
iónica
As moléculas de água não se deslocam pela
acção de um campo eléctrico mas a parte positiva do dipolo orienta-se para o
cátodo e a negativa para o ânodo.
As moléculas de água comportam-se do
mesmo modo em relação aos iões,
constituindo à volta de cada ião uma bainha de moléculas de água, a bainha
de solvatação. .


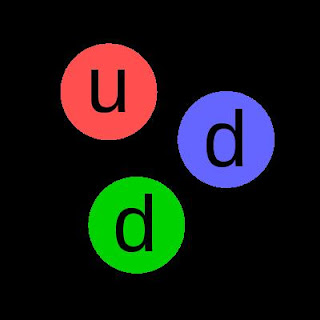













































































































1xbet korean registration - What is 1xbet - legalbet.co.kr
ResponderEliminar1xbet korean registration - What is 1xbet live 1xbet, what is 1xbet and what does it mean to make a sportsbook account? 1xbet korean is a bookmaker that accepts bets on